鸡蛋清蛋白磷酸化改性及功能性质的研究
随着食品工业的发展,具有特定功能特性的蛋白质成为研究的热点。目前,人们一方面极力开发具有优良特性的蛋白质资源;另一方面是对现有的蛋白质进行一些改造,以满足人们的特殊需求[1-3]。蛋白质的理化性质和功能特性直接相联系。蛋白质的改性就是基于结构决定功能的这一基本原理,用物理因素或生化因素使其氨基酸残基和多肽链发生变化,引起蛋白大分子空间结构和理化性质的改变,在不影响其营养价值的基础上,来获得较好的功能特性[4-5]。其中磷酸化改性是蛋白质的化学改性蛋白的一种,主要优势在于改性后的蛋白溶解度的提高和等电点的降低,从而达到改变其功能特性的目的[6-7]。而且蛋白质磷酸化已经被认为是提高蛋白功能性的有效手段。相关的研究报道有:如Matheis[8]针对酪蛋白的磷酸化进行了研究,确定了酪蛋白的磷酸化条件;Sung等[9]使用多聚磷酸钠在碱性条件下对大豆蛋白进行了磷酸化,确定了最佳的磷酸化条件,且制取的磷酸化大豆分离蛋白的水溶性、持水能力、乳化能力和发泡能力等功能性质大大改善;Huang等[10]分析了磷酸化酵母蛋白的溶解性和持水力也有所增加。李瑜[11]采用多聚磷酸钠对小麦面筋蛋白进行磷酸化研究;卢寅泉[12]采用三聚磷酸钠对大豆分离蛋白进行了化学改性,并对磷酸化分离蛋白的水溶性、乳化性、发泡性、持水能力等功能性进行了研究;熊柳等[13]对花生分离蛋白进行了磷酸化改性研究。但以上研究中针对鸡蛋清蛋白的磷酸化研究报道很少,虽然徐保立等[14]研究了食品添加剂对鸡蛋蛋清凝胶强度的影响,发现磷酸盐随种类的不同对蛋清凝胶强度的影响而不同,但对蛋清磷酸化改性并未进行深入研究。
鸡蛋蛋白是人类食品的重要蛋白质来源之一,而其中鸡蛋清蛋白具有广泛的功能性质,如溶解性、吸水性、保水性、胶凝性、乳化性和发泡性等,每种功能特性都能使食品具有特定的加工性能。蛋清蛋白的各种功能特性在同一产品中是同时起作用的,但在加工过程中,它的这些特性可能会发生变化,可能会造成不良的影响。因此,利用各种方法来对鸡蛋清蛋白进行改良以适应不同产品的需要已经成为迫切需要解决的问题。为进一步改善蛋清蛋白的加工特性,拓展鸡蛋清蛋白在食品中的应用,本文采用三聚磷酸钠(sodium tripolyphosphate,简称STP)对蛋清蛋白进行磷酸化改性研究,并针对其功能性质进行了探讨,以期为鸡蛋清磷酸化改性工业化生产提供参考和借鉴。
1 ·材料与方法
1.1 材料与设备
新鲜鸡蛋市售,蛋壳清洁、无异味、无破裂,打开后蛋黄凸起、完整,蛋白澄清透明、稀稠分明、无异味,内容物不得有血块及其他组织异物;STP、浓硫酸、硫酸铜、硫酸钾国药集团化学试剂有限公司,均为AR;牛血清白蛋白Bio-Rad公司,BR;其他试剂均为国产分析纯。
Avanti J-E型超速冷冻离心机美国BeckmanCoulter 公司;UV1800 型紫外分光光度仪美国MAPADA公司;KDN-2C型定氮仪上海纤检仪器有限公司;FD-1型真空冷冻干燥机北京德天佑科技发展有限公司;高速分散机江阴精达化工机械;QSL-08型数控消化炉北京强盛分析仪器制造中心。
1.2 实验方法
1.2.1 蛋清粉的制备
打开检验合格的鲜鸡蛋,采用分离器将蛋清与蛋黄分离,将蛋清液采用高速分散机,以35r/s搅拌20min,静置1h后弃除底层脐带等杂质,真空冷冻干燥得到蛋清粉备用。
1.2.2 磷酸化反应条件优化
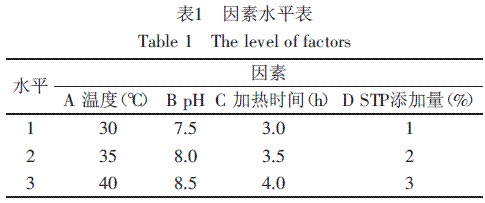
针对影响鸡蛋清蛋白磷酸化的四个主要因素:温度、pH、加热时间、STP添加量,通过单因素和正交实验,以磷酸化程度为考察指标,确定其最优化的工艺组合。因素水平表见表1。
1.3 测定指标与方法
1.3.1 粗蛋白测定采用
凯氏定氮法[15]。
1.3.2 水溶性蛋白含量的测定
称取经凯氏定氮法校正的牛血清蛋白50mg(精确至0.0001g),配成50mL标准溶液,再分别取0.1、0.2、0.3.0.4、0.5、0.6、0.7、0.8、0.9、1.0mL标准溶液稀释至10mL使其浓度在0.1mg/mL范围内,280nm处测定吸光度,绘制标准曲线。称取0.500g蛋清蛋白配制浓度为1%(w/v)的蛋清蛋白水溶液50mL,置于磁力搅拌器上中速搅拌1h,静置30min后3000r/min离心15min,取上清液0.5mL稀释20倍在280nm处测定吸光度[12]。
1.3.3 磷酸化程度的测定
将一定量蛋清粉溶入磷酸盐缓冲液中,调节pH,加入一定量的STP,将反应容器置于一定温度的水浴锅中,不断搅拌使之反应一定时间,反应结束后调pH到7.0,用中空纤维膜超滤除去小分子盐,取反应液5mL,加入三氯乙酸(trichloroacetic acid,简称TCA)溶液使其中的蛋白质沉淀,离心后向上清液中加入1mol/L的Zn(Ac)2 2mL,使其中的焦磷酸在pH3.8~3.9条件下以Zn2P2O7的形式沉淀,然后用pH10的氨缓冲液溶解焦磷酸锌,用铬黑T做指示剂,用0.01mol/L的EDTA-Na2标准溶液滴定,当溶液的颜色由紫红变成蓝色时即为滴定终点[16]。计算公式如下[17]。
磷酸化程度(mg/g)=c×(V2-V1)×MP/2m
其中:c:EDTA-Na2标准溶液的浓度,mol/L;V1:滴定空白所耗EDTA-Na2标准溶液的体积,mL;V2:滴定样品所耗EDTA-Na2标准溶液的体积,mL;MP:磷的相对原子质量为30.97;m:样品中鸡蛋清蛋白的质量,g。
1.3.4 蛋清蛋白的水溶性的测定方法
蛋白质的溶
解度采用氮溶解指数(NSI)和蛋白质分散指数(PDI)表示。本文以蛋白质分散指数PDI为指标比较磷酸化前后蛋清蛋白的溶解性变化。PDI=水分散蛋白质/总蛋白质[18]。
1.3.5 保水性的测定方法
向5g干试样中加入50mL热水,搅拌均匀,放置20min,用1000r/min离心机离心5min,去除分离水,测定残留物的质量[19]。按以下公式计算出保水性。

1.3.6 蛋清蛋白乳化性测定方法
称取3g样品溶于50mL蒸馏水中,调节pH8.0,加入50mL花生油,在高速组织捣碎机中均质(1000~1200r/min)2min后,再采用1500r/min离心5min,分别测定离心管中乳化层高度和液体总高度,按以下公式计算出乳化性[12]。
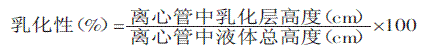
1.3.7 蛋白质乳化稳定性测定方法
称取3g样品溶于50mL蒸馏水中,调节pH8.0,加入50mL花生油,在高速组织捣碎机中均质(10000~12000r/min)2min,置于50℃水浴中30min后,测出此时的乳化层高度,乳化稳定性计算如下[13]:

2 ·结果与分析
2.1 鸡蛋清蛋白原料中蛋白质的含量
对实验所采用的鸡蛋清蛋白原料中的蛋白质含量进行测定,结果表明蛋清粉中粗蛋白含量为78.63%±2.11%,含量非常高,对本研究非常有意义。而水溶性蛋白质含量为83.13%±3.52%,说明鸡蛋蛋白的溶解性能较好;资料表明好的溶解性可以明显增加蛋白质的潜在功能[12]。
2.2 磷酸化反应条件的单因素实验
2.2.1 温度对鸡蛋清蛋白磷酸化程度的影响
将蛋清蛋白在25、30、35、40、45、50℃温度下反应,得出不同温度下磷酸化程度,其变化结果如图1所示。
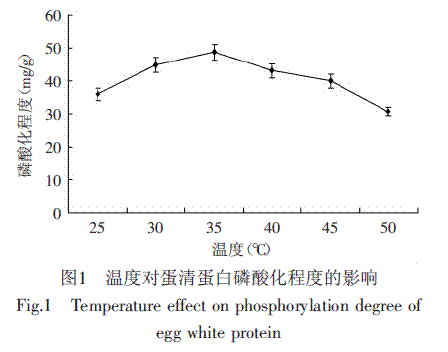
鸡蛋清蛋白磷酸化程度随着温度的增大呈现先增大而后下降的变化(见图1),在35℃时达到最大值48.85mg/g显著高于25℃的磷酸化程度(p<0.05)。原因是由于温度影响反应速率,温度越高反应速率越快,然而,当温度超过35℃持续上升时,其会影响鸡蛋清蛋白质羟基活性,反而会降低了磷酸化的程度,到50℃时,磷酸化程度达到显著性的降低(p<0.05)。因此选用35℃为适宜的反应温度。
2.2.2 pH对鸡蛋清蛋白磷酸化程度的影响
将鸡蛋清蛋白在不同pH(7.5~9.5)条件下进行反应,测定的磷酸化程度结果见图2。
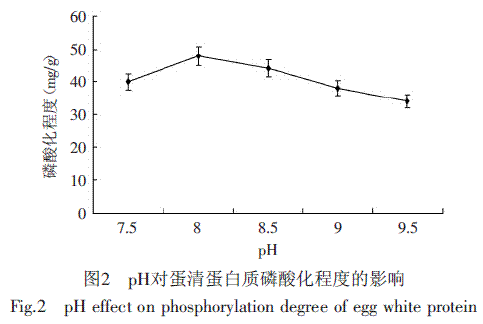
图2表明,蛋清蛋白的磷酸化程度与pH呈现先增后下降的显著性的变化趋势,在pH=8.0时达到最大值48.00mg/g(p<0.05)。其原因是,蛋白质上氨基在碱性环境中表现活性,使反应更容易进行[16],因而鸡蛋清蛋白的磷酸化程度也相应较高。但在pH过高的环境下,蛋白质受碱的影响而变性,阻碍其与磷酸根相结合,因此磷酸化程度降低。因此实验选用pH8.0作为较优的反应pH。
2.2.3 加热时间对鸡蛋清蛋白磷酸化程度的影响
鸡蛋清蛋白在不同加热时间(2.5~4.5h)下反应,得到不同时间下磷酸化程度,其结果见图3。
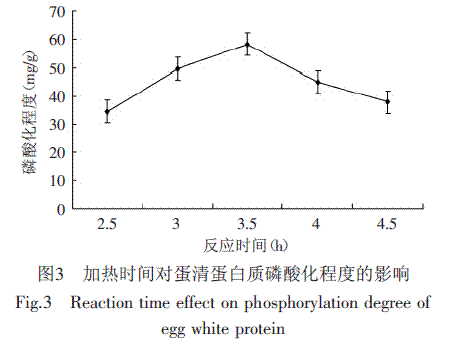
加热时间对蛋清蛋白的磷酸化有一定的影响作用;随时间的延长磷酸化程度相应明显升高,在3.5h处磷酸化程度最大58.23mg/g(p<0.05),达到显著水平;而后随着反应时间的延长,磷酸化程度呈现显著性的下降趋势。此种趋势表明,蛋白磷酸化反应在一定时间范围内进行,超过改性的加热时间,蛋白质之间产生斥力作用,造成磷酸化程度下降。因此鸡蛋清蛋白磷酸化的选用加热时间为3.5h为宜。
2.2.4 STP添加量对鸡蛋清蛋白磷酸化程度的影响
针对不同STP添加量(1%~5%),对鸡蛋清蛋白进行磷酸化改性,测定磷酸化程度的结果见图4。
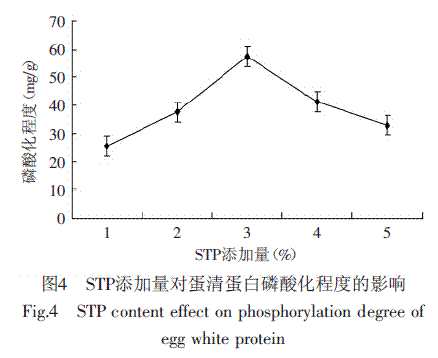
图4表明,随STP添加量的增大,鸡蛋清蛋白的磷酸化程度呈现先增大而后下降的趋势,当STP的添加量为3%,磷酸化程度达到最大为57.46mg/g(p<0.05),达到显著水平。其原因是,反应初期,随着STP添加量增加,磷酸根不断增加,则蛋白的磷酸化程度随底物的增加则不断增大;当磷酸根达到饱和状态时,只有某些特定的氨基酸基团可以与磷酸根结合;当持续增加STP添加量后,蛋白质之间的静电斥力加大,阻碍磷酸化反应,因此磷酸化程度反而降低。因此实验确定较优的STP添加量为3%。
2.2.5 正交实验确定最佳的磷酸化工艺参数
在以上单因素实验确定较优化工艺参数的基础上,针对各因素进行正交实验L9 ( 34),正交实验结果见表2。
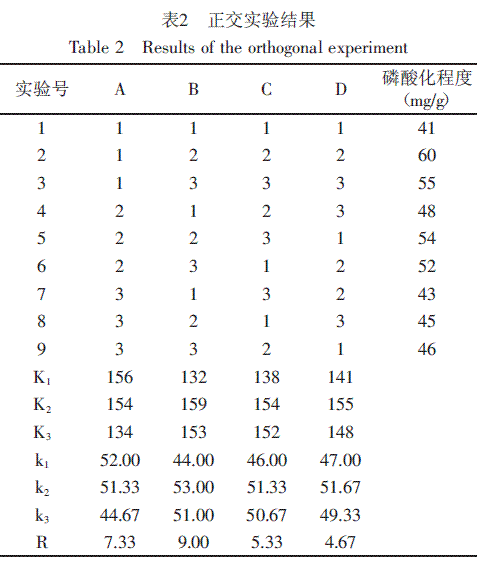
从表2中的极差值R可以看出各因素影响磷酸化程度的主次顺序为:B>A>C>D,即:pH>温度>加热时间>STP添加量。确定最佳工艺组合为A1B2C2D2,即:温度30℃,pH为8.0,加热时间为3.5h,STP添加量为2.0%。该组合为正交表中第二组实验,磷酸化程度为最大值60mg/g。
2.3 蛋白质磷酸化功能特性的研究
2.3.1 蛋白的水溶性和保水性的变化
用氮分解指数(PDI)为指标测定磷酸化前后鸡蛋清蛋白的水溶性,同时测定保水性的变化,其结果见图5。
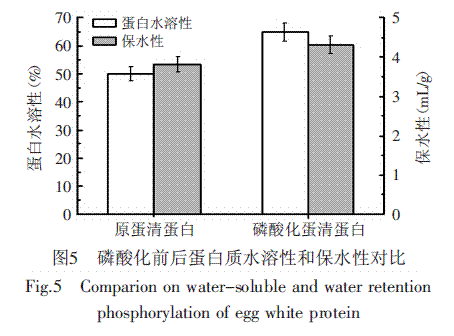
由图5可知,磷酸化后鸡蛋清蛋白的水溶性比磷酸化前的增加了29.74%,磷酸化后蛋白质的保水性提高了13.26%。原因是由于当介质pH高于pI值时,蛋白质带负电,以负离子的形式存在,破坏了蛋白质分子的水合膜,从而使蛋白质溶解度升高。而且磷酸化使蛋白质分子上的电荷分布发生了变化,由于带净电荷的磷酸基使水化作用增强,静电斥力能够使蛋白结构松散化,持水力也有所增加,因此保水性增大。
2.3.2 乳化性及乳化稳定性
根据实验方法测定磷酸化前后鸡蛋清蛋白的乳化性和乳化稳定性,其结果如图6所示。
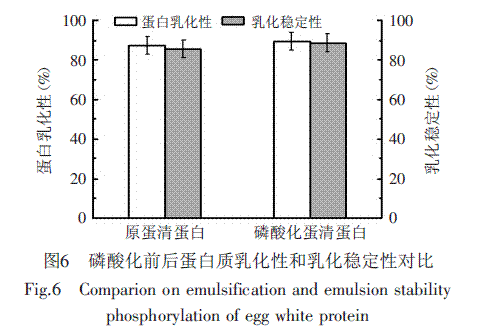
从图6可知,蛋清蛋白经磷酸化改性后,其乳化性及乳化稳定性均有所提高,分别提高了2.27%和3.53%。主要原因是磷酸化后,蛋白质中引入更多负电荷,降低了乳化液的表面张力,使之更易形成乳状液滴;同时负电荷的引入又增加液滴之间的斥力,更易分散,这使得更多的疏水基团暴露出来,提高了蛋白质的亲油性。有利于蛋白质更好地在油/水界面重排定位,因此乳化能力会随着磷酸化程度的变大也明显提高。蛋白质的乳化性能与其溶解性存在密切的相关性,因为溶解度越大,参与乳化作用的蛋白质分子就越多,从而增强油/水界面之间的薄膜的形成,防止或者减缓液滴絮凝和聚结[12]。
2.4 SEM观察改性前后鸡蛋清蛋白的微观聚集态变化
采用SEM针对磷酸化前后的鸡蛋清蛋白进行微观聚集态观察,结果见图7。

从图7可知,改性前后两者之间微观结构区别不是很明显。微观图显示的颗粒结构表明,蛋白质球体紧密相连,改性前后鸡蛋清蛋白的排列规则都较为紧密。
3·结论
3.1 本研究通过单因素和正交实验,确定最佳的磷酸化工艺参数组合为:温度30℃、pH为8.0、加热时间为3.5h,STP添加量为2.0%,在此条件下,磷酸化程度达到60mg/g。
3.2 经磷酸化改性后,鸡蛋清蛋白的功能特性发生了改变。其中,水溶性提高了29.74%,保水性提高13.26%,乳化性及乳化稳定性略有提高,分别提高了2.27%和3.53%。但SEM观察改性前后鸡蛋清蛋白的微观结构区别不是很明显。总体来讲,磷酸化改性后,蛋清蛋白的功能特性有一定的改善,增加了蛋白质的利用范围。