植物多糖分离提取技术的研究进展
植物多糖是由十个以上单糖通过糖苷键聚合而成的一种天然生物大分子,其相对分子质量可达数万甚至数百万。近年来,随着糖生物学的不断发展,越来越多的植物多糖被分离、鉴定出来,而且研究发现这些植物多糖具有不同的生物学活性,如免疫调节、降血糖、降血脂、抗肿瘤、抗病毒、抗凝血等[1-7]。与此同时,越来越多的临床应用研究表明,一些植物多糖在对治疗肺纤维化、哮喘、慢性支气管炎、心肌缺血再灌注损伤等有显著效果[8-12]。由于植物多糖来源广泛,具有独特的药理活性且安全无毒副作用等优点,它逐渐成为新药、功能保健品、绿色食品添加剂和临床应用中极具潜力的发展方向。但是,作为植物多糖产业中的关键环节,其提取、分离纯化仍然存在很多缺陷,如提取周期长、分离工艺繁杂、多糖成分复杂以及产品得率低等问题。本文主要综述植物多糖提取、分离纯化的研究进展,并简要结合南方红豆杉枝叶中单组份多糖提取、分离纯化工艺对植物多糖的提取、分离纯化进行了展望。
1 ·植物样品的预处理
植物样品一般先经过粉碎机粉碎,粉碎后的样品与溶剂的接触面积增大,浸出率提高; 但由于样品太细会导致后续脱脂或提取粗多糖时过滤的困难,所以粉碎后的样品需要过筛,通常选取40 ~ 50 目筛。
植物枝叶细胞外有脂质包围,在水浸提前需要脱脂,否则多糖被包裹在里面,不能被提取出来。植物多糖脱脂常采用索氏提取器回流提取或搅拌萃取,脱脂溶剂为甲醇、乙醇、60 ~ 90 ℃石油醚等。Wen 等[13]在用超声辅助提取溪黄草多糖前,先采用95% 乙醇回流提取脱脂。Togola 等[14]在提取山柚叶中的多糖前,以二氯甲烷为溶剂,经索氏提取器回流脱脂,并接着依次用80%乙醇、甲醇浸泡脱脂。Wu 等[15]在用热水提取南方红豆杉多糖前,先以石油醚为溶剂,经索氏提取器回流脱脂。
2 ·植物多糖的粗提
随着对植物多糖提取研究的深入,植物多糖的提取方法除了传统的热水提取法之外,更有效、更节能、更快速的多糖提取方法不断被发现,例如,超声波辅助提取,微波辅助提取,酶辅助提取,酸碱提取法等。
超声波辅助提取主要是通过超声波的空化作用和强烈震动,破碎原料细胞壁,促进多糖的溶出,提高多糖的得率。该法与传统热水提取法相比,大大缩短提取时间,减少能耗。如: Zhong 等[16]对龙眼干中多糖的超声波辅助提取进行了研究,经响应面优化的龙眼多糖提取条件为,超声波频率680 W,水料比25ml /g,提取时间为4. 5 min,多糖得率为4. 455%,与传统热水提取法相比,时间大大缩短。杨芳等[17]研究了超声波辅助提取法对板栗多糖的提取,优化后的最佳工艺条件为超声波处理时间35 min,超声波处理功率100 W,水浴提取时间60 min,在此条件下的板栗多糖提取率为13. 94%,是传统热水提取法的2. 23 倍,而且与传统热水提取法提取板栗多糖的时间150 min 相比,超声波辅助提取法的提取时间缩短了1. 5 倍。此外,超声波具有较强的剪切作用,处理时间长会导致大分子多糖化学键断裂,降低多糖提取率。
微波辅助提取法主要是利用微波穿透能力强和加热迅速的特点,植物样品细胞内的极性物质尤其是水分子吸收微波能量产生大量热量,细胞内部温度迅速上升,使细胞内液态水汽化,产生压力冲破细胞膜和细胞壁,从而促进多糖的溶出。微波辅助提取多糖的时间很短,往往只需要几十分钟甚至几十秒,且提取率高。如: Zhao 等[18]对兰州百合多糖的微波辅助提取进行了研究,经响应面优化的提取条件为,微波处理功率597 W,提取时间60 min,原料与溶剂比1∶ 65,提取温度50 ℃,得到的多糖提取率高达36. 55%,这比传统热水提取法所耗时间更少、耗能低而且多糖提取率高。王莉等[19]研究了微波辅助提取米糠多糖的工艺,同样经响应面优化的工艺条件为,料液比1 ∶ 10,微波功率为400 W,微波辐射时间为2 min,这不仅比传统热水提取法的提取时间120 min 短得多,而且多糖提取率2. 76%也比传统热水提取法的高。微波辅助提取时间不宜长,功率也不宜过高,否则会导致水分蒸发过多,多糖不易溶出,导致多糖得率下降,此外,微波可能导致多糖活性降低或丧失、被降解、结构变化等[20]。
酶辅助提取法是利用酶反应的高度专一性将植物细胞壁降解,使得多糖被释放而被提取,此法多糖提取率高。Ge 等[21]研究了酸浆果实花萼中多糖的提取,比较了传统热水提取法、超声波辅助提取法和酶辅助提取法之间的差异,结果表明,在对酸浆果实花萼的多糖提取中,酶辅助提取法的最优多糖提取率为8. 581%,远大于传统热水提取法和超声波辅助提取法的最优多糖提取率2. 92%和3. 67%。Zhang 等[22]对酶辅助提取宁夏枸杞多糖进行了研究,响应面优化的条件为,复合酶浓度( 纤维素酶浓度2%,木瓜蛋白酶浓度1%) ,提取温度59. 7 ℃,提取pH 5. 0,提取时间91 min,得到的多糖产率为6. 81%。但是酶辅助提取法对实验条件要求高,需要考虑最适温度、pH、最适作用时间、酶浓度等因素,此外,多糖提取液中的酶不易清除干净。
酸提取法是用适宜浓度的乙酸或盐酸将含葡萄糖醛酸等酸性基团的多糖提取出来,此法需要严格控制酸作用的时间,而且多糖可能发生酸水解,另外,提取结束后需要立即用碱迅速中和并透析,否则会降低多糖的提取率。如: 韩贺东等[23]采用响应面法对酸提糯米多糖工艺进行了优化,在提取温度88. 8 ℃,盐酸浓度0. 322 mol /L,液固比22. 1∶ 1,浸泡时间30 min,提取次数2 次,提取时间55. 5 min 时得到最大多糖提取率13. 79%。碱提取法是用弱碱性溶剂将含有糖醛酸的多糖提取出来,提取结束后也需要立即用酸迅速中和并透析,否则会降低多糖的产率。Yang 等[24] 先后用5% NaOH 溶液与10% NaOH 溶液在4 ℃下处理山茱萸果实样品4 h 提取多糖。
另外,研究表明一些新的集成提取法大大减少了植物多糖的提取时间,增加了提取率,如微波-超声波辅助提取法、缓冻协同微波辅助提取法、超声-酶辅助提取法等。丁宏伟等[25]采用微波-超声波辅助提取技术提取南瓜中的多糖成分,并与传统的热水浸提方法进行了比较,结果提取率提高了80%,而且时间大大缩短。李超柱等[26]先后采用热水浸提法、微波辅助提取法、缓冻提取法、缓冻热水提取法和缓冻协同微波结合热水提取法提取甘薯多糖,结果表明按缓冻协同微波结合热水提取法得到的多糖提取率最高,提取率为26. 6%;缓冻协同微波结合热水提取法综合了缓冻、微波、热水提取三种技术的优点,缓冻可以使植物细胞内产生较粗大的冰晶,冰晶越粗大,细胞组织越易受伤,甚至被锐利的冰晶体戳破,因此缓冻能够强化多糖的提取,提高细胞的破碎率; 微波穿透性好,加热迅速; 热水提取不会发生酸水解,可保持多糖大分子结构,因此与其他提取法相比,缓冻协同微波结合热水提取法对多糖的提取率大大提高。Chen 等[27]利用超声-酶辅助提取法提取羊藿叶中多糖,经响应面优化的最佳条件为,复合酶用量包含木瓜蛋白酶50 U/g、果胶酶250 U/g、纤维素酶200U/g、α-纤维素酶100 U/g,提取温度46. 8 ℃,超声功率311 W,pH 4. 28,提取时间42. 3 min,得到的多糖提取率为5. 98%。
3· 植物多糖的脱色
高纯度天然多糖一般是白色,但是由于多糖的来源不同以及提取方法的缺陷,常常使得到的植物多糖粗提液含有大量色素,为了对多糖的定性分析、结构测定以及药效检测不产生影响,在分离纯化得到单组份多糖前,通常考虑先对植物多糖粗提液进行脱色处理。现在主要的脱色方法是活性炭脱色、双氧水脱色和树脂脱色等。
活性炭是黑色细微多孔性物质,它靠范德华力将色素吸附到自身表面,活性炭脱色法具有对杂质吸附能力强、脱色成本低且不会影响提取物的生物活性等优点,但是需要考虑的影响活性炭脱色效果的因素很多( 活性炭的质地、pH 值、活性炭用量、温度以及脱色时间等) ,并且往往脱色时间长、脱色率越高,相应的糖保留率会越低; 此外,经活性炭脱色后的植物多糖提取液中会有很多微小的活性炭颗粒存在,而且很难过滤和除掉。陈宝等[28]研究了迷迭香多糖活性炭脱色工艺,在其脱色最佳工艺条件( 活性炭用量1%,脱色时间60 min,脱色温度80 ℃) 下,脱色率达82. 44%,但多糖保留率仅为55. 72%。
H2O2在水溶液中可以电离出过氧氢根离子HO2-氧化色素,影响H2O2脱色的因素也有很多,如用量、温度、pH 值及脱色时间; H2O2脱色效果很好,但是由于其氧化性极强,易破坏多糖原始结构与活性,且不宜操作,需要少量的缓慢添加并不断搅拌,稍微过量就可能导致糖保留率骤降甚至多糖被完全氧化。卢国勇等[29]研究了鱼腥草多糖的双氧水脱色工艺,在最佳脱色工艺条件( 60 ℃,pH 9. 0,加入双氧水量30%,反应4 h)下,脱色率高达96. 56%,但是糖保留率比活性炭脱色后的保留率低得多,只有19. 28%。
利用树脂脱色已经成为一种较常见的脱色方法,而且效果较好,但是由于不同来源的植物多糖提取液中所含色素性质和多糖的性质都有不同,所以若采用树脂脱色,常常需要取一系列不同极性、非极性的大孔吸附树脂或强弱不同的阴阳离子交换树脂进行试验和对比,从中选择脱色效果好、糖保留率高的树脂。利用大孔吸附树脂脱色的优点主要表现在树脂具有很强的物理吸附能力,可以从水溶液中有选择地吸附有机物质,且理化性质稳定,不溶于酸、碱及有机溶剂,不受无机盐类及强离子低分子化合物存在的影响,但是它只适合于处理量少、粘度小、色素含量低的样品,而且脱色会造成树脂的污染,且再生困难,成本较高。高晶晶等[30]分别对款冬花多糖的双氧水法脱色工艺、活性炭吸附脱色工艺、反胶束溶液脱色工艺和大孔吸附树脂脱色工艺进行了研究与对比,活性炭法与双氧水法对多糖脱色都有相当大程度的多糖损失,反胶束法脱色效果不好,脱色率很低,而大孔吸附树脂脱色工艺对款冬花多糖提取液脱色率可达94. 19%,且多糖保留率为73. 02%,是四种脱色方法中对款冬花多糖提取液脱色最好的。
由于不同来源的多糖粗提液中色素的性质不同,且与多糖的理化性质有很大差异,有的时候用离子交换树脂能更好的将多糖提取液中的色素除去。离子交换树脂对植物多糖粗多糖溶液的脱色过程除了有物理吸附作用,也存在离子交换。
4· 单组份植物多糖的高纯度分离
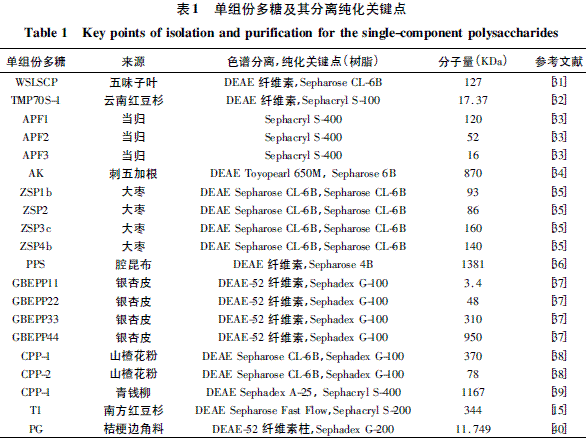
单组份植物多糖的分离纯化主要采用离子交换色谱和凝胶过滤色谱。离子交换色谱法主要用于将植物多糖粗提液中的单组份多糖粗分开,通常采用梯度洗脱法。凝胶过滤色谱用于将离子交换分离得到的复合组分分开或者脱盐。一些新的单组份多糖经离子交换色谱与凝胶过滤色谱分离、纯化得到,其分子量和涉及的主要色谱介质相应列出,如表1 所示。在该表所参考的多糖分离研究中,Yang 等[33]对当归多糖的分离直接采用一次凝胶过滤分离,虽然得到了两个多糖组分,但纯度不高; Xu 等[31]分离五味子叶多糖、Han 等[34]分离刺五加根多糖、Xie[39]等分离青钱柳多糖都先采用离子交换色谱初步分离,得到的粗分组分再经凝胶过滤进一步纯化,二次分离并没有达到最佳的分离效果,主要是因为相关研究者在进行离子交换色谱时,只采用单一浓度盐溶液或去离子水进行洗脱,没有考虑离子交换色谱分离的洗脱液选择与其浓度梯度变化,不能达到离子交换色谱分离的最佳效果; 而其他参考的多糖分离研究不仅采用了离子交换色谱与凝胶过滤色谱二次分离,还选取了适当pH 和浓度的缓冲液用于离子交换色谱,此外洗脱过程中采用盐浓度变化的梯度洗脱更加有利于不同性质的多糖组分的分离,达到了单组份高纯度分离效果。因此,对单组份植物多糖的高纯度分离应采用离子交换色谱初步分离,并对离子交换色谱分离的缓冲液pH 与浓度进行选择优化,进行盐浓度变化的梯度洗脱,得到的粗分组分再经凝胶过滤色谱进一步纯化。
5 ·展望
前文总结了在植物多糖分离提取过程中常用的植物样品预处理方式,植物多糖粗提技术与脱色技术,和在此基础上建立的一些新的集成提取技术,结合对具体研究的分析阐明了得到高纯度单组份植物多糖的最佳分离纯化过程与要求。
随着新药、功能保健品、绿色食品添加剂产业的发展,对天然活性物质的需求加剧,植物多糖分离提取技术的发展越来越重要。植物多糖分离提取技术发展方向可以从两个方面来考虑:
( 1) 根据已有的植物多糖提取方法,将两种或两种以上提取方法的优势结合起来,形成一种新型的集成提取植物多糖的方法,以达到快速、节能、高提取率的效果。
( 2) 在分离纯化植物多糖的步骤中,采用组合分离纯化技术,例如串联色谱分离纯化技术等,得到单组份多糖。
这些新的集成提取或分离纯化技术的开发和应用,将有利于新的单组份植物多糖的发现,推动植物多糖产业的发展。但是,由于植物多糖的来源繁多,粗提液组成复杂,其提取与分离纯化会非常艰难,因此,研究人员需要在熟练掌握各种分离纯化技术的前提下,对植物多糖的理化性质、稳定性以及与杂质性质之间的差异做一定的了解,以便合理的选择和设计分离纯化工艺,探寻出有效的分离提取植物多糖的工艺。