婴幼儿食品和乳制品中维生素B12测定的探讨
根据国内外目前的相关资料,目前测定维生素B12主要有4种方法:比色法、原子吸收分光光度法、高效液相色谱法及微生物法。其中微生物法是通用方法,该法灵敏度很高,但由于该法操作关键点多,微生物生长周期长,成本高等问题而不能广泛应用。但对于含量低,且低于仪器检出限的维生素仍然需要微生物法进行测定,公职分析化学家协会(AOAC)和美国药典(USP)以及中国国家标准GB5413.14—2010都将微生物法作为维生索Bb测定的主要方法和仲裁方法,仪器法作为辅助方法。微生物法的高灵敏度和可靠性已得到国际权威机构的认可。所以推广微生物法很有意义。
1· 维生素B12特性及功能
维生素B12是人体内每天需要量最少的一种,过量的维生素B12会产生毒副作用。据报道注射过量的维生素B12可出现哮喘、荨麻疹、湿疹、面部浮肿、寒颤等过敏反应,也可能相发神经兴奋、心前区痛和心悸。维生素B12摄入过多还可导到叶酸的缺乏[1]。尤其对婴幼儿奶粉的控制量更为重要, 在国标GB 10765-2010中明确规定一段奶粉维生素B12标准量为0.025~0.360 μg/100 kJ, 较大婴儿配方奶粉维生素B12量为≥0.04 μg/100 kJ[2]。

2 ·微生物法与高效液相色谱法比较
根据国内目前的相关资料,测定维生素B12主要有微生物法[4]和高效液相色谱法[5]。高效液相色谱法大都用于保健食品、药品及维生素预混料等样品,该类样品一般维生素B12质量分数较高或基质简单, 易于检测。
目前有关液相色谱法测定维生素B12方法中检出限一般都不能满足奶粉专用维生素添加剂的测定。如国家药品标准中规定的方法[6],测定液中要求在10 μg/mL 以上;测定饲料添加剂时,测定液中要求在40 μg/mL左右。而奶粉专用复合维生素添加剂中的维生素B12质量分数一般为10 μg/g或更低(国标规定婴幼儿配方奶粉中维生素B12质量分数≥0.8 μg/100 g, 即维生素添加剂质量分数一般应在800 μg/ 100 g 以上)[7],若称取样品量为10 g左右(称样量过大样品无法完全溶解及会影响色谱柱分离),定容至50 mL时,测定液中维生素B12含量约为2 μg/mL; 且许多样品中的维生素B12质量分数低于10 μg/g, 制备液甚至在1 μg/ mL以下,所以用于测定此类样品中维生素B12质量分数的方法必须达到一定的检出限。另外在奶粉专用复合维生素添加剂中除含有10多种维生素外, 还有其他杂质。这些组分质量分数远高于维生素B12质量分数,要通过色谱柱进行有效分离并准确定量测定,在选择合适的色谱柱的同时, 还需研究相应的测定条件及样品处理方法。因此,液相色谱法测定维生素B12有较明显的局限性,对于乳制品中维生素B12的测定更为困难。微生物法是测定如食品中维生素B12的通用方法,微生物是生长旺盛,继代时间短,比表面积很大的生命体。微生物对环境的高度依赖性决定了微生物法的高度灵敏性。可测定出样液中0.01 ng/mL的质量浓度。若认定一台仪器,固定其工作状态和测定条件,则该方法可消除因仪器而产生的一些误差。
综上分析, 高效液相色谱HPLC测定的是跟维生素标准品具有相同化学结构的维生素,跟生物活性没有直接关系,导致:①没有生物活性的维生素被检测;②具有生物活性但化学机构与标准品不同的维生素漏测,只有具有生活活性的维生素才能被人或者动物吸收利用。微生物法利用微生物对于某种维生素的特异性和灵敏性,测定的正是具有生物活性的一部分维生素。
3 ·实验原理
利用莱士曼氏乳酸杆菌(Lactobacillus leichmannii)对维生素B12的特异性和灵敏性,定量测定出试样中维生素B12的质量分数。在测定用培养基中供给除维生素B12以外的所有营养成分,这样微生物生长产生的透光率就会同标准曲线工作液及未知待测溶液中维生素B12的质量分数相对应。以不同浓度标准溶液的透光率相对于各浓度水平标准物质的浓度绘制标准曲线,根据标准曲线即可计算出试样中维生素B12的质量分数。
4· 实验
4.1 仪器
具体参见标准GB5413.14—2010。试管和移液管处理:由于碱性的洗涤剂会对莱士曼氏乳酸杆菌的生长起到促进作用,所以如果洗刷不干净的试管会让菌种长的过于旺盛,导致实验不成梯度,实验失败。试管内的油渍也会促进菌种的生长,所以所用到的玻璃器皿的清洗尤为重要, 是实验成败的重要因素之一,也是很多实验室最容易犯的错误之一,建议单独使用固定试管。正确做法是硬玻璃测定管用洗涤剂进行清洗,,或用20%(体积分数)盐酸浸泡处理,再用蒸馏水多次冲洗,再在200 ℃干热2~3 h。其他必要的玻璃器皿可以用洗液直接清洗,冲洗干净待用。介绍一种强酸氧化剂洗液: 强酸氧化剂洗液是用重铬酸甲(K2CrO7)和浓硫酸(H2SO4)配成。K2Cr2O7在酸性溶液中,有很强的氧化能力,对玻璃仪器又及少有侵蚀作用。所以这种洗液在实验室内使用最广泛[8]。
4.2 试剂
维生素B12标准品:分子式C63H88CoN14O14P,纯度为99.8%,计算浓度时纯度参与计算。
培养基:乳酸杆菌琼脂培养基,乳酸杆菌肉汤培养基,维生素B12测定用培养基。
5 ·菌种复活与传代
根据莱士曼氏乳酸杆菌(Lactobacillusleichmannii)ATCC7830的特点,该菌种生命力不强,在维生素B12斜面上存活时间比较短,需要定期传代、作为工作菌种的一般储存状态。为了实验数据稳定性和重复性好,菌种最好只使用2~5代, 防止代数过多菌种变异或者污染导致特性减弱或引入杂菌影响实验结果,菌种活力直接影响实验成败,要提出特别注意。菌种在斜面一般5~7 d就需要传一代。维生素B12肉汤用于实验前一天的增菌,不适宜用于菌种保藏。短期保藏可以用质量分数为30%甘油肉汤储藏,冷冻干燥(脱脂乳洗脱冷冻干燥)保藏可以用于菌种的长期储藏。也可以用成品的菌种保藏管长期保存[9]。表2为不同培养基特点及用途。

6· 标准液的制备
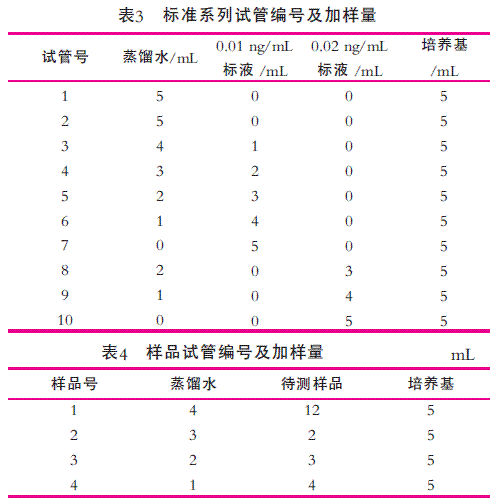
具体参见标准GB5413.14—2010。在做稀释时候可以根据实验室具体情况另作调整,比如可以吸取2 mL到100 mL和200 mL容量瓶中,同样制备成高浓度溶液的质量浓度为0.02 ng/mL;低质量浓度溶液的质量浓度为0.01 ng/mL。所有标准溶液要储存于冰箱内,中间工作液保存期3个月,工作液临用前配制。
7 ·样品处理
称一定量的样品(含维生素B12约50~100 ng,一般奶粉样品按最低限称取,因为一般含量偏高,固体样品要注意粉样均匀, 液体吸取时要用大肚移液管吸取,大肚移液管要清洗干净不能挂壁,移取样品时擦干大肚移液管外壁液体,防止取样不精确。称取时不能超过25 g最大称取量, 防止水解释放不完全。加入10 mL缓冲溶液时要充分混匀之后再加入150 mL蒸馏水。内源性(天然)的维生素是和蛋白质结合存在的。必须经热或酶分解成游离态才能被测定,提取目的就是释放出维生素。帮助样品中维生素B12水解时很好释放。冷却后调pH值至4.5±0.2, 使得样品中蛋白质沉淀,确保溶液澄清,溶液的浑浊对测吸光度影响很大,如果被测样品无法澄清就做无菌空白试样(只加培养基不加菌), 计算时减本底吸光度值。再用水定容至250 mL,过滤。移取滤液5 mL,加入水20~30 mL,调pH至6.8±0.2,此处调节pH值是保证维生素B12和莱士曼氏乳酸杆菌在pH中性中培养,用水定容至100 mL。最终溶液中维生素B12的质量浓度约在0.01~0.02 ng/mL。
水解后的样品可以在冰箱内储藏3 d左右,稀释后的样品不可以储藏用于下次实验。表3为标准系列试管编号及加样量;表4为样品试管编号及加样量。
8 ·实验过程
8.1 灭菌
系列和样品的所有的试管盖上试管帽,121 ℃灭菌5 min(商品培养基按标签说明进行灭菌)。可将需要的维生素B12测定用培养基根据需要一同灭菌。灭菌时要保持试管间适当的间隙,维持空气流通,尽量保证实验条件一致。
8.2 菌悬液制备
将培养好的菌悬液置于离心机中离心,去上清液加入10 mL灭菌高纯水混匀反复离心3~4次再加入10 mL灭菌高纯水待用。
8.3 接种
将上述试管迅速冷却至30 ℃以下,培养基冷却至45 ℃左右,加菌量的控制很重要,决定了实验的成败,莱士曼氏乳酸杆菌从维生素B12斜面接到维生素B12肉汤后培养时间不适宜过长,一般过夜后第二天早上观察菌量及时停止培养,以免菌种大量生长,造成老化,影响实验比色结果。用灭菌的高纯水洗脱菌3~4次,并用紫外分光光度计测试透光率, 以生理盐水做空白,透光率一般在60%~80%为宜,75%的透光率500 mL的培养基加菌0.5 mL,混匀培养基,用灭菌滴管向上述试管中各滴加5 mL培养基(其中标准曲线管中空白1除外),加菌也可以用移液枪加菌悬液。加菌量的控制和重要, 如果菌量加多了培养24 h后系列和样品生长浊度过高而导致不成梯度, 无法比色而实验失败,或者导致不加菌空白浑浊, 即使系列线性很好的情况下,也会使实验数值便高。如果加菌量少了,培养24 h后系列和样品生长浊度过低而需要继续培养,延长实验时间。
8.4 培养
将加完菌的试管用涡旋混合器混匀,放入恒温培养箱内,36 ℃ ± 1℃培养19~20 h,培养时要保持试管间适当的间隙,维持空气流通,尽量保证实验条件一致。能用摇床式培养更好,混匀帮助生长。20 h左右要随时观看比色浊度, 再用涡旋混合器混匀帮助生长,随时准备比色。
8.5 比色
最佳比色时间是系列最高浓度的透光率在30%左右,确保2 h之内透光率变化小于2%即可读取数据,可以确保透光率拉开梯度,太低的透光率使系列拉不开导致斜率低。如果把握不好比色终点可多做几根系列高浓度点,培养18 h后每隔一个小时比色一次判断比色终点,当透光率梯度不明显时可用吸光度值测定结果。
8.6 数据处理
根据样品的透光率由计算公式求出相应质量分数,每支试管测得的浓度不得超过该平均值的±15 %,超过者要舍去。符合该要求的管数少于所有的4个编号的待测液的总管数的2/3, 用于计算试样质量分数的数据是不充分的, 需要重新检验。两次实验数据不得超过平均值的±10%。
9 ·结果与讨论
9.1 标准系列
建议做3个平行, 在取舍的时候选择性和对比性更好,系列是决定实验成败的关键因素,长期实验证明,同样的样品反复多次实验,样品透光率基本不会有大变动,变化的是系列本身,从而导致结果变化。样品第一次做可以做两个平行,找到合适的称取量范围之后再做3个平行来分析出数, 这样在保证实验数据精准的前提下可以减少实验成本。
9.2 回收率
吸取102 ng/mL的标准工作液1 mL作为质控样和样品做同样前处理、水解、稀释、加样、加菌、培养、比色,一般回收率在95%左右。标准系列读水平范围内,回收率在80%~110%之间,相对标准偏差小于10%。方法的回收率和精密度符合GB/T 27404-2008《实验室质量控制规范食品理化检测》中检测方法确认对回收率和精密度的技术要求。本方法简便、准确、适合乳粉中维生素B2的检测。