饮料中常用防腐剂、甜味剂和色素的检测
食品安全问题是世界各国高度关心、影响广泛的重要问题。我国近年来虽然在各方面做了大量的工作,努力维护公众饮食安全,但我国市场经济自身约束机制与诚信体系还不完善,仍处于食品药品安全事故和质量风险的高发期。我国现有食品生产企业近13万家,食品添加剂生产企业3000多家,食品经营主体700多万户,且多为小规模分散经营。这都给我国食品安全监管带来巨大挑战。
目前最为突出的问题是非法添加非食用物质和滥用食品添加剂。一些不法分子见利忘义,在食品生产经营中非法添加或滥用食品添加剂,严重危害群众健康和生命安全。近年来的一系列食品安全事件,大多与此有关。因此,当前食品安全的关键就是解决非法添加和滥用添加剂的问题,而要实现这一目标的重要一步就是加强检测。
当前食品工业中最常用的添加剂就是:防腐剂(山梨酸、苯甲酸),甜味剂(糖精钠、乙酰磺胺酸钾)、色素(柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红),也是日常各地监管部门最常检测的12种添加剂。但各种添加剂的检测方法各不相同,目前国标[1-4]及文献[5-8]报道的分析方法多是针对这些添加剂中的一种或几种,而关于这12种食品添加剂同时检测的报道甚少,这使得检测工作需要做很多遍,不仅时间长,工作量大,还降低了工作效率。因此建立一种快速、准确且能够同时测定食品中这12种食品添加剂的检测方法十分必要。
为此作者选取目前食品检测机构最常用的基于紫外检测器的高效液相色谱法,同时检测饮料类食品中12种添加剂的含量,该方法操作简单、快速准确、灵敏度高,适用于饮料中多种添加剂的测定。
1· 材料与方法
1.1 主要材料与试剂
柠檬黄标准液;苋菜红标准液;日落黄标准液;胭脂红标准液;亮蓝标准液;靛蓝标准品;诱惑红标准品;赤藓红标准品;苯甲酸标准液;山梨酸标准液;糖精钠标准品;乙酰磺胺酸钾标准品;以上标准品均购自国家标准物质研究中心。甲醇(色谱纯),美国迪马公司;乙酸铵(分析纯),天津市化学试剂三厂;氨水(分析纯),天津市化学试剂三厂;微孔滤膜:聚四氟乙烯0.45 μm。
1.2 主要仪器与设备
Agilent 1100高效液相色谱仪:配有紫外检测器,美国Agilent公司;台式高速离心机:济南福的机械有限公司;超声波清洗仪:上海狄昊实业发展有限公司;旋涡混合器:上海五相仪器仪表有限公司;固相萃取小柱:Waters Oasis WAX (6 mL/500 mg)。
1.3 样品
超市购买的碳酸饮料、果汁饮料、乳饮料、茶饮料和功能饮料,共5种。
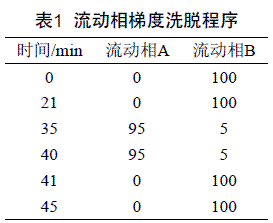
1.4 色谱条件 色谱柱:Agilent XDB-C18(4.6 mm×250 mm,5μm);柱温:20.0 ℃;流动相:A:甲醇;流动相B:乙酸铵溶液(0.02 mol/L+5%甲醇),梯度洗脱见表1;流速1 mL/min;进样量10 μL;检测器:紫外检测器;检测波长:色素254 nm(其中诱惑红500 nm、亮蓝是630 nm其余均为254 nm)、山梨酸和苯甲酸230 nm、糖精钠和乙酰磺胺酸钾214 nm。
1.5 样品处理
1.5.1 碳酸饮料、茶饮料和功能饮料
称取液体样品50 g,温热超声除去CO2,用稀氨水(浓氨水按体积比1:1加入蒸馏水)调pH值到7。纯水定容于100 mL容量瓶中后经0.45 μm滤膜过滤,取5 mL,过Oasis WAX柱(预先经5 mL甲醇、5 mL水、5 mL2%的甲酸水溶液活化),依次以2%甲酸清洗10 mL清洗,5%氨水甲醇溶液5 mL洗脱,氮吹浓缩到1mL进样。
1.5.2 果汁饮料、乳饮料
称取液体样品5 g于100 mL容量瓶中,加入25mL乙醇:氨水:水(9:0.5:1)混合溶剂匀浆,涡旋1min后超声提取30min,离心,残渣重复提取2次,合并提取液,旋蒸定容10mL,0.45 μm滤膜过滤,取5 mL过Oasis WAX柱(预先经5mL甲醇、5 mL水、5 mL 2%的甲酸水溶液活化),依次以2%甲酸清洗10 mL清洗,5%氨水甲醇溶液5 mL洗脱,氮吹浓缩到1 mL进样。
2· 结果与分析
2.1 标准曲线及检出限
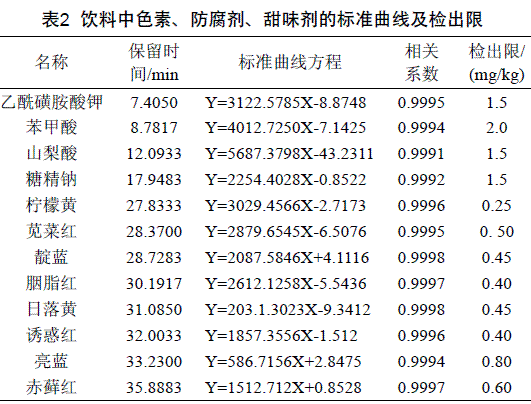
将12种标准品用水配制成浓度分别为:0.02、0.05、0.08、0.10 mg/mL的标准溶液,每个样测3次,取3次测定结果的平均值,进样分析,得到色谱图,以峰面积为纵坐标,时间为横坐标,获得标准曲线,计算线性回归方程及相关系数(表2)。选择254 nm检测色素,其中亮蓝为630nm、诱惑红为500 nm取得是可见波长,这是因为在紫外下两者灵敏度较低,该波长处响应值较高,但为简化方法适当牺牲部分化合物的响应值,选择254 nm为检测波长。山梨酸和苯甲酸选择230 nm、糖精钠和乙酰磺胺酸钾选择214 nm。在该检测波长下,基线平稳,且方法检出限能够满足检测要求。
2.2 实际样品中回收率的测定
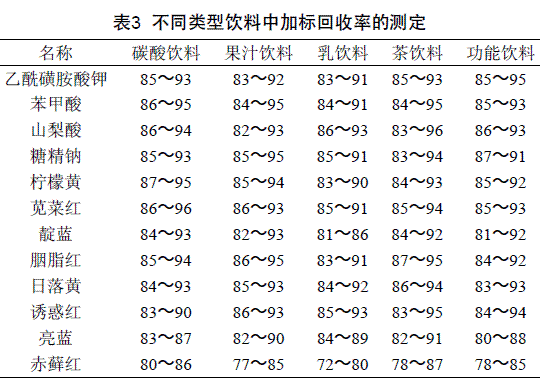
取碳酸饮料等5种不同类型不含本文添加剂的饮料各5个共25个样品进行检测,用本方法称取5.00 g,分别加入一定量的标准品溶液,使12种添加剂浓度分别为0.02、0.05、0.80、0.10 mg/mL。以此溶液为加标样品,按“1.5样品处理”方法进行处理后检测,结果见表3。食品基质较为复杂时,由于不同着色剂的性质差异大,很难用一种方法同时实现对多种类着色剂的提取净化,本方法对5种饮料基质设计前处理方案,回收率虽然随基质不同而有所变化,但定量准确、迅速、重现性好。
3 ·讨论
3.1 前处理的选择
文中甜味剂和合成色素均易溶于水,2种防腐剂既溶于水又溶于有机溶剂。因此许多文献介绍了采用样品稀释液经0.45 μm滤膜过滤后直接进样法,但这仅适合于基质简单的样品;对于基质复杂的样品,直接进样对色谱柱不利,且样品中含量不一定均匀,滤液难以代表添加剂的平均含量[9-10]。适当的前处理有利于去除杂质,平稳基线。
饮料前处理困难往往在于蛋白的去除,文献经常采用乙酸锌-亚铁氰化钾除蛋白或乙腈提取硅藻土柱净化方法,但在去除蛋白的过程山梨酸、苯甲酸、色素往往与蛋白被一同沉淀,降低回收率[11-12]。
本实验采用氨水乙醇水溶液进行提取。糖精钠、苯甲酸和山梨酸在碱性条件下均以盐的形式存在,可以溶于强极性的溶剂。乙酰磺胺酸钾易电离即使在酸性条件下也以阴离子形式存在,极易溶于水。乙醇对含乳饮料、果汁可起到沉淀胶体减少干扰的作用;而70%~75%的乙醇可以夺取蛋白质的水分,使蛋白质相对过量,相互吸附、凝聚从而提取出与蛋白质结合的色素。对不同比例的氨水乙醇水溶液进行比较,最终确定实验比例。
氨水乙醇水溶液不仅提取了目标物,而且提取了样品中的糖和某些脂溶性成分等,为去除干扰、平稳基线,在提取后继续使用了Oasis WAX柱进行固相萃取。
几种甜味剂和防腐剂同时带有有机基团和可离子化基团,在中性和偏酸性条件下,电离受到抑制,主要以中性分子的形式存在反相柱上有一定保留。而赤藓红为苯甲酸钠结构,也存在一定保留,其他合成色素为苯磺酸钠结构含有磺酸基,是强阴离子化合物适合弱阴离子交换萃取柱。最终确定为水可浸润性聚合物吸附剂,Oasis WAX混合型弱阴离子交换反相吸附柱,可以有效地去除杂质干扰,回收率高。实验发现赤藓红回收率偏低,可能是由于其自身的苯甲酸钠结构,在固相萃取小柱上保留较弱;而且甲醇及甲酸可部分洗脱赤藓红。
3.2 流动相的选择
流动相是色谱分离中十分重要的影响因素,直接关系到分析的各个方面。实验首先选取纯水-甲醇为流动相发现效果不佳,这是因为在中性条件下,部分苯甲酸和山梨酸在流动相中以阴离子的形式存在,与固定相之间的相互作用较弱;而酸性流动相可使苯甲酸和山梨酸在溶液中主要以中性分子形式存在,增加了与固定相之间的相互作用。而甜味剂与色素不受pH值影响。
缓冲盐中乙酸铵含有的羧酸基团可对酸性的类磺胺化合物(乙酰磺胺酸钾、糖精钠)与羧基化合物(山梨酸、苯甲酸)有更强的洗脱能力,因此采用乙酸铵以调节流动相环境。当乙酸铵浓度过高时,易与甲醇混合至过饱和而析出,过低则起不到作用,实验选用0.01、0.02、0.03、0.04 mol/L,发现在0.02 mol/L时各添加剂得到有效分离,峰形最佳;浓度再增大对洗脱能力、分离度无明显增强。
对乙腈-乙酸铵和甲醇-乙酸铵2个流动相体系进行实验,乙腈-乙酸铵无法使色素有效分离,因此选用甲醇-乙酸铵流动相体系。选用不同比例流动相进行实验,发现当甲醇浓度过高时,乙酰磺胺酸钾与糖精钠不能基线分离,因此最终在A:甲醇,B:乙酸铵溶液(0.02 mol/L+5%甲醇)时进行梯度洗脱,可以实现添加剂的完全分离且分析时间较短,因此选用该流动相比例。
3.3 干扰试验
在实验条件下,食品中可能存在的某些物质对乙酰磺胺酸钾与糖精钠测定造成干扰。食品通常组成成分复杂,极有可能存在与乙酰磺胺酸钾与糖精钠性质接近的物质,给分析造成干扰。如果忽略了这类干扰,就会影响结果判定。如果出现超标或阳性样品应做加标试验,谨慎结论。
3.4 实际样品
在优化条件下对秦皇岛市场上的部分饮料开展了检测工作。结果显示,目前市场上的饮料中添加防腐剂、甜味剂、色素较为常见,但未发现非法添加行为。检测发现,摊位零售的散装果汁饮料类大多含有食用合成色素和乙酰磺胺酸钾或糖精钠,但并未超过GB 2760-2011《食品添加剂使用标准》规定限量。
4 ·结论
目前对于几种添加剂往往分别单独检测,即使一些文献报道也多以防腐剂、甜味剂、色素三类分别检测,或防腐剂和甜味剂同时检测[7,13-16]。而关于三类添加剂同时检测的研究报道比较少,主要是样品基质复杂,前处理回收率或高或低难以一致,造成了大量人员与物质的浪费[17-19]。本研究通过对饮料基质进行实验研究,优化选择蛋白沉淀剂和固相萃取柱,建立了适合的前处理技术,进而通过色谱柱及流动相的选择,进一步优化色谱条件,对食品添加剂建立了一套系统性和完整性的高效液相色谱检测方法。但本文方法仅适用于不含酒精的饮料类产品,发酵酒中复杂的基质使糖精钠和乙酰磺胺酸钾与部分样品杂质很难有效分离,无法依靠紫外检测器准确检测,目前解决方法多以离子对色谱、液质联用、离子色谱法进行。
实验最终确定以乙醇:氨水:水提取样品,Oasis WAX固相萃取小柱净化,高效液相色谱法梯度洗脱和波长切换,一次进样同时检测饮料中的苯甲酸、山梨酸、乙酰磺胺酸钾、糖精钠、柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红12种添加剂的含量,使饮料中对添加剂分析有影响的干扰成分得到有效分离,该方法样品前处理得到简化,数据准确可靠,重现性好,检出限低,回收率较高,可以满足GB 2760-2007《食品添加剂卫生标准》中,饮料类食品中各种食品添加剂的规定使用量的检测要求,可用于饮料类食品的食品安全检测工作。